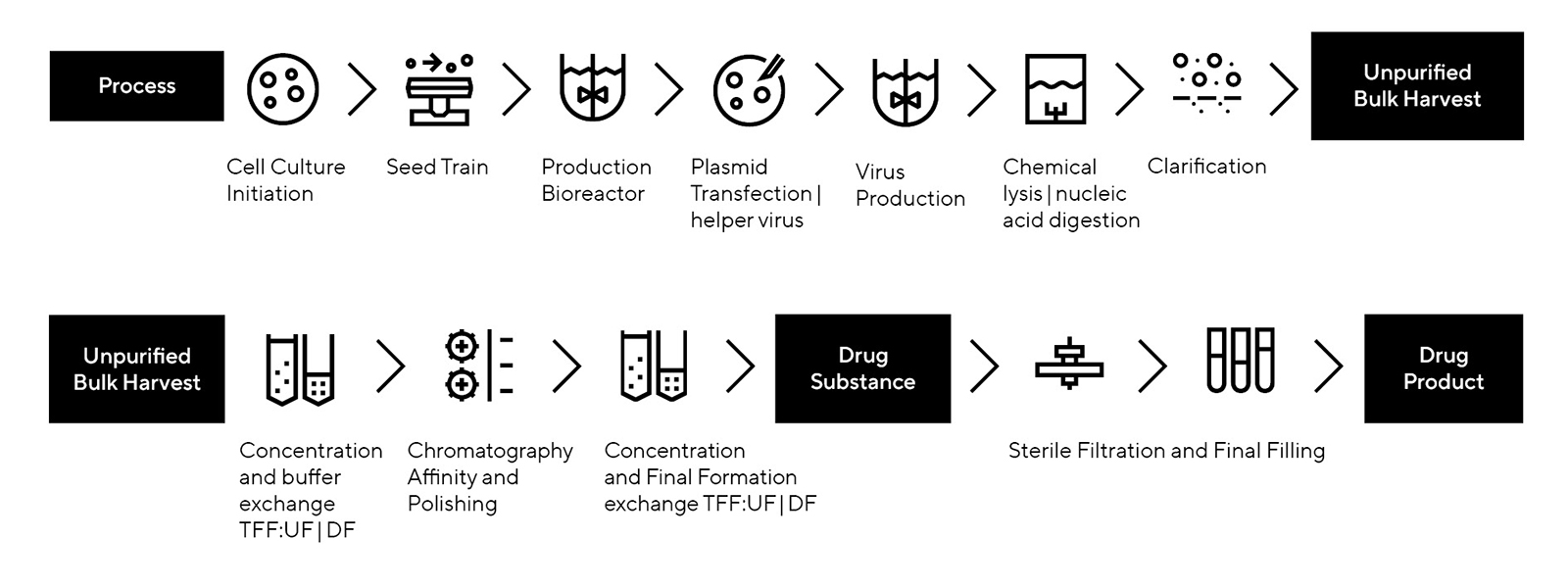
探索研究から商業化までの包括的なAAV検査サービス
アデノ随伴ウイルス(AAV)は、長時間な遺伝子発現、非病原性、非常に低い免疫原性といった遺伝子導入における利点を提供します。
しかしながら、AAVの製造には課題が伴います。規制要件は複雑かつ変化し続けており、血清型を超えて凝集が生じ、製品には完全なカプシド、空のカプシド、部分的に充填されたカプシドが形成される可能性があります。またAAVは非複製性であるため、プロセスおよび製品の特性解析が極めて困難となります。
ザルトリウスは、お客様のAAV製造をサポートするため、研究開発段階から規制当局の承認取得に至るまで、AAV試験サービスを提供しております。経験豊富で専任のチームによる専門知識と、保証された試験枠をご用意しております。
AAVの特性解析手法
規制要件を容易に順守する
規制環境は複雑かつ変化し続けております。当局は常に新たなAAVガイダンスを発表しており、わずかな手違いでも承認プロセスに時間を要し、コスト増となる可能性があります。
当社はお客様と連携し、安全性、同一性、純度、有効性などの指標に基づくAAVの特性解析を、開発・確立・バリデーションいたします。当社のチームは、FDAおよびEMA/CATの承認取得経験に加え、韓国、日本、中国のガイドラインに関する知見も有しております。
以下の属性をテストする方法
製品の固有のアイデンティティーを確認し、製品またはプロセスの他の構成要素と区別してください。
- カプシドのアイデンティティー
- 対象遺伝子
- 全ゲノム配列
完成品が不純物を最小限に抑えていることをご説明ください。
- 全量:空殻カプシド比
- 残留物HCP、DNA、BSA、ベンゾナーゼ、リガンド、およびプラスミド
- トランスフェクション剤および界面活性剤
- 残留物トランスフェクション試薬 (FectoVIR®-AAV および PEIpro®に対する特定の方法を含む )
- 凝集
貴社の医薬品の治療効果を定義してください。
- 感染性
- ゲノム滴度
- ウイルス異物力価
製品がウイルスや微生物などの外来物質を含まないことを保証してください。
- 無菌性およびマイコプラズマ
- エンドトキシン
- 外来ウイルス
- 複製能:rcAAV
- 種特異性ウイルス
初期開発段階における製品特性解析の簡素化
初期のプロセス開発では、試験方法を外部委託することで、基本的な製品特性解析にかかる時間を短縮できます。当社の選択と専門知識により、お客様はプロセス開発に集中することが可能となり、最終的な収量を向上させ、より早く次の開発段階へ進むことができます。
初期段階から臨床試験への移行を円滑に進める
AAV医薬品候補が前臨床試験の準備が整ったと判断された場合、製造メーカーは製品およびプロセスに関連する不純物を評価し、完全な特性解析を実施する必要があります。
当社の幅広い製品特性解析(一般的な製品品質および物理化学的特性を含む)により、AAV製品の臨床試験導入をサポートいたします。当社の試験方法は、規制要件の達成とアッセイの汎用的な適格性確認を支援するよう設計されております。
後期開発および商業化をスピードアップする
後期臨床試験への移行および商業化を進めるには、規制要件を満たす完全な製品特性解析に加え、お客様の特定のAAV製品および開発段階に適合したバリデートされた試験法が必要となります。
当社の事前認定済み試験方法とoff-the-shelfアッセイを活用することで、迅速なターンアラウンドを実現いたします。製品固有の最適化が必要な場合でも、当社チームは最も一般的に使用されるAAV血清型向けにアッセイを開発・認定しております。
試験方法及び規制ガイドライン
以下の表は、規制ガイドラインで義務付けられている試験方法の概要と、各開発段階で実施すべき試験内容を示しております。
ザルトリウスの製品ポートフォリオ
ザルトリウス社の遺伝子細胞治療ソリューションをさらにご提供いたします
私たちは、人生を変える遺伝子細胞治療の開発という皆様の使命を共有しております。再現性のある性能とスケーラビリティを実現するエンドツーエンドのソリューションにより、規制当局の承認取得プロセスを簡素化し、商業化を加速させます。
よくあるご質問 - AAVサービス
はい、当社は臨床段階および商業段階における規制対応を支援するGMP準拠の方法を提供しております。また、前臨床段階に適した非GMP方法もご用意しております。
当社のAAV試験は、FDAおよびEMA/CATのガイダンスならびに韓国、日本、中国の規制当局のガイダンスに準拠しております。
2020年1月、FDAは「ヒト遺伝子治療治験薬アプリケーションのための化学的・製造的・制御情報に関する業界向けガイダンス( FDA CBER 2020年1月)」 を発行しましたが、 欧州では依然として「遺伝子治療医薬品の品質、非臨床および臨床的側面に関するガイドライン(EMA/CAT/80183/2014)」が適用されています。
各ガイダンス文書では、全ての医薬品について安全性、アイデンティティー、純度、および有効性が保証されていることが求められています。
はい、承っております。こちらのページに掲載されていない方法にご興味がおありでしたら、お気軽にお問い合わせください。当社は15年以上にわたり、お客様向けの方法の開発と提供を行ってまいりました。
その他のウイルスベクターに関する試験についてご検討の際は、お気軽にお問い合わせください。
既存の検査およびセルバンキングサービスに加え、AAV検査専用の検査枠をご用意しております。世界中での対応が可能で、リードタイムについては毎週更新いたします。